ตั้งแต่เริ่มต้นยุคของการปฏิวัติอุตสาหกรรมในช่วงปลายศตวรรษที่ 18 และการเร่งพัฒนาทางเศรษฐกิจ และสังคมที่ดำเนินมาอย่างต่อเนื่องตลอดช่วงศตวรรษที่ 19 เพิ่มความต้องการใช้พลังงานเชื้อเพลิงในการสนับสนุนกิจกรรมทางเศรษฐกิจ ตลอดจนการปลดปล่อยก๊าซคาร์บอนไดออกไซด์ (CO2) เข้าสู่ชั้นบรรยากาศให้เพิ่มมากขึ้น และส่งผลให้ความเข้มข้นของก๊าซ CO2 ในบรรยากาศเพิ่มขึ้นจากประมาณ 330 ppm ในปี ค.ศ. 1975 เป็น 410 ppm ในปี ค.ศ. 2019 และส่งผลสืบเนื่องให้เกิดการเปลี่ยนแปลงสภาวะภูมิอากาศ อุณหภูมิอากาศที่เพิ่มสูงขึ้น การละลายของน้ำแข็งขั้วโลก การเพิ่มขึ้นของระดับน้ำทะเลโดยเฉลี่ย และการละลายเพิ่มขึ้นของก๊าซ CO2 ในลงสู่มหาสมุทรซึ่งได้รับการพิจารณาเป็นแหล่งกักเก็บคาร์บอนขนาดใหญ่ของโลก จากการศึกษาได้มีการประมาณว่าร้อยละ 33 ของก๊าซ CO2 ที่เกิดจากการเผาไหม้เชื้อเพลิงในกิจกรรมทางเศรษฐกิจในช่วง 200 ปีที่ผ่านมา ได้ถูกดูดซับไว้โดยมหาสมุทร อย่างไรก็ตาม การละลายเพิ่มขึ้นของก๊าซ CO2 ลงสู่มหาสมุทรกลับส่งผลต่อการเปลี่ยนแปลงทางเคมีในน้ำทะเล หรือการเปลี่ยนสมดุลในระบบคาร์บอเนตในน้ำทะเล ซึ่งจะแสดงผลในรูปแบบของค่าความเป็นกรดหรือด่าง (pH) ในน้ำทะเลที่ลดลง
ในกระบวนการทางเคมี เมื่อก๊าซ CO2 ละลายลงสู่น้ำทะเลและอยู่ในสถานะ CO2 ละลายน้ำ (สมการที่ 1) ถัดมา CO2 จะทำปฏิกิริยากับโมเลกุลน้ำ (H2O) และก่อให้เกิดกรดคาร์บอนิก (H2CO3) ซึ่งจะแตกตัวต่อ และให้ไฮโดรเจนไอออน (H+) พร้อมกับโมเลกุลของไบคาร์บอเนต (HCO3–) (สมการที่ 2)
CO2 (g) <-> CO2 (aq) (1)
CO2 (aq) + H2O <-> H2CO3 <-> H+ + HCO3– (2)
ในสภาวะที่น้ำทะเลมีค่าความเป็นกรดหรือด่าง (pH) โดยทั่วไประหว่าง 7.5-8.5 ไฮโดรเจนไอออนมีแนวโน้มที่จะดึงเอาโมเลกุลของคาร์บอเนต (CO32-) ในน้ำ มาก่อตัวเป็น HCO3–(สมการที่ 3)
H+ + CO32- <-> HCO3– (3)
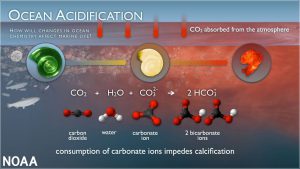
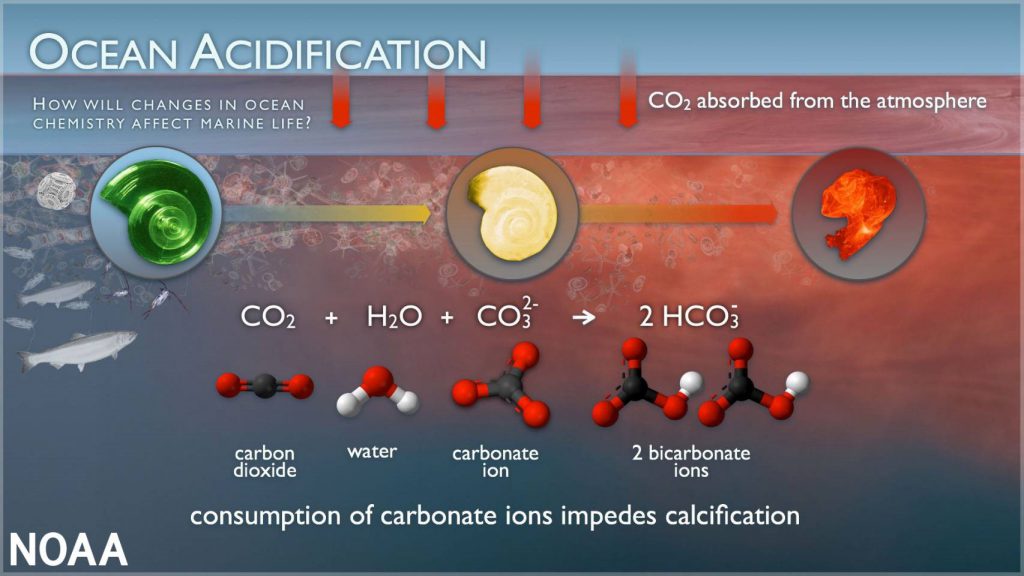
และส่งผลความเข้มข้นของ CO32- ในน้ำทะเล รวมทั้งต่อการเปลี่ยนแปลงความอิ่มตัวของคาร์บอเนต (Ω) ในน้ำทะเล ทั้งนี้ เนื่องจาก CO32- ในทะเลส่วนใหญ่ สามารถละลายอยู่ในน้ำหรืออยู่ในรูปของโครงสร้างแคลเซียมคาร์บอเนต (CaCO3) ดังนั้น การละลายเพิ่มขึ้นของ CO2 จึงสามารถส่งผลกระทบต่อโครงสร้างแคลเซียมคาร์บอเนต (CaCO3) โดยลักษณะของผลกระทบจากการเปลี่ยนแปลงความเข้มข้นของ CO32- และค่า Ω ในน้ำทะเล ที่อาจมีต่อสิ่งมีชีวิตในทะเลที่มีโครงสร้างแคลเซียมคาร์บอเนต อาจเชื่อมโยงได้ตามรูปที่ 1
รูปที่ 1 ผลของการเปลี่ยนแปลงความเป็นกรดของน้ำทะเลที่มีต่อสิ่งมีชีวิตที่มีการสร้างเปลือกในทะเล
(ที่มาhttp://www.noaa.gov/education/resource-collections/ocean-coasts/ocean-acidification)
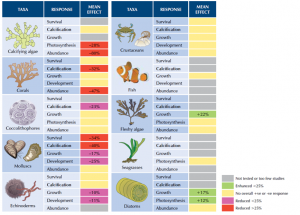
สิ่งมีชีวิตในทะเลมีบทบาท หน้าที่ และความสำคัญต่อมนุษย์ที่หลากหลาย เช่น แพลงก์ตอนพืชมีบทบาทสำคัญในการเป็นผู้ผลิตลำดับต้น กุ้ง ปู หรือหอย มีคุณค่าทางเศรษฐกิจ และปะการังมีความสำคัญต่อสัตว์น้ำในการเป็นแหล่งอนุบาล ที่หลบภัย และเป็นที่อยู่อาศัย สิ่งมีชีวิตในทะเลเหล่านี้ มักมีการสร้างเปลือกหรือโครงสร้างซึ่งมีองค์ประกอบของ CaCO3 การศึกษาในอดีต (เช่น Freely et al., 2008; Bednaršek et al., 2012; Jokiel, 2013; Kroeker et al., 2012; Albright et al., 2016) พยายามอธิบายรูปแบบ และขนาดของผลกระทบจากการเปลี่ยนแปลงความเป็นกรดของน้ำทะเลโดยการพิจารณาเทียบเคียงทั้งจากในสภาพธรรมชาติ หรือจากการทดลองในห้องปฏิบัติการ Knoeker et al. (2013) ได้สรุปภาพรวมของผลกระทบที่อาจมีต่อสิ่งมีชีวิตชนิดต่าง ๆ รวมทั้งกลุ่มสิ่งมีชีวิตที่อาจได้รับประโยชน์จากการเปลี่ยนแปลงนี้ (รูปที่ 2) ทั้งนี้ เพื่อพิจารณาโดยมุ่งเน้นที่ผลกระทบที่เกิดผ่านกระบวนการ Calcification แล้ว จะพบว่าปะการังและกลุ่มหอย มีแนวโน้มที่จะได้รับผลกระทบเพิ่มขึ้น เพื่อประเมินผลกระทบระดับของผลกระทบที่อาจเกิดขึ้นในอนาคต การศึกษาในอดีต (เช่น Kleypas et al., 1999; Guinotte et al., 2003; Guan et al., 2015) เสนอแนะการใช้ค่าความอิ่มตัวของอะราโกไนต์ (Ωar) ในการพิจารณาผลกระทบ โดยกำหนดให้ค่าระหว่าง 2.82-3.28 เป็นระดับที่อาจจะเริ่มส่งผลกระทบต่อการเจริญเติบโตของปะการัง
รูปที่ 2 ขนาดผลของการเปลี่ยนแปลงความเป็นกรดของน้ำทะเลที่มีต่อสิ่งมีชีวิตในทะเล (Laffoley and Baxter, 2015 อ้างถึง Knoeker et al., 2013)
นอกจากจะส่งผลกระทบในเชิงลบแล้ว การเปลี่ยนแปลงความเป็นกรดของน้ำทะเลที่ยังอาจส่งผลให้สิ่งมีชีวิตบางประเภทได้รับผลเชิงบวกได้ เช่น สาหร่ายขนาดใหญ่ หรือไดอะตอม (รูปที่ 2) ดังนั้น ลักษณะของผลกระทบอาจปรากฏได้ในรูปแบบที่หลากหลาย เช่น การเปลี่ยนผ่านเชิงโครงสร้างขององค์ประกอบสิ่งมีชีวิตในระบบนิเวศ หรือการเปลี่ยนแปลงลักษณะและการปรับตัวของกลุ่มประชากรของสิ่งมีชีวิต (Connell and Russell, 2010; Kroeker et al., 2012; Kroeker et al., 2013; Celis-Plá et al., 2015; Harvey et al., 2016; Thomsen et al., 2017; Agostini et al., 2018; Doney et al., 2020) ซึ่งล้วนส่งผลต่อความอุดมสมบูรณ์ของระบบนิเวศในทะเลทั้งสิ้น
เรียบเรียงโดย ดร.เฉลิมรัฐ แสงมณี
เอกสารอ้างอิง
Agostini, S., B.P. Harvey, S. Wada, K. Kon, M. Milazzo, K. Inaba, and J.M. Hall-Spencer. 2018. Ocean acidification drives community shifts towards simplified non-calcified habitats in a subtropical−temperate transition zone. Sci. Rep. 8, 11354 (2018). https://doi.org/10.1038/s41598 018-29251-7.
Albright, R., Caldeira, L., Hosfelt, J. L. Caldeira, J. Hosfelt, L. Kwiatkowski, J.K. Maclaren, B.M. Mason, Y. Nebuchina, A. Ninokawa, J. Pongratz, K.L. Ricke, T. Rivlin, K. Schneider, M. Sesboüé, K. Shamberger, J. Silverman, K. Wolfe, K. Zhu, and K. Caldeira. 2016. Reversal of ocean acidification enhances net coral reef calcification. Nature 531, 362–365. https://doi.org/10.1038/nature17155
Bednaršek, N., G. A. Tarling, D. C. E. Bakker, S. Fielding, E. M. Jones, H. J. Venables, P. Ward, A. Kuzirian, B. Lézé, R. A. Feely, and E. J. Murphy. 2013. Extensive dissolution of live pteropods in the Southern Ocean. Nature Geosci 5, 881–885 (2012). https://doi.org/10.1038/ngeo1635
Connell, S.D., and B.D. Russell. 2010. The direct effects of increasing CO2 and temperature on non-calcifying organisms: increasing the potential for phase shifts in kelp forests. Proc. R. Soc. B 277, 1409–1415. doi:10.1098/rspb.2009.2069
Celis-Plá P.S.M., J.M. Hall-Spencer, P.A. Horta, M. Milazzo, N. Korbee, C.E. Cornwall, and F.L. Figueroa. 2015. Macroalgal responses to ocean acidification depend on nutrient and light levels.Front.Mar.Sci.2:26. doi: 10.3389/fmars.2015.00026
Doney, S.C., D.S. Busch, S.R. Cooley, and K.J. Kroeker. 2020. The Impacts of Ocean Acidification on Marine Ecosystems and Reliant Human Communities. Annu. Rev. Environ. Resour. 45:83–112
Feely, R.A., C.L. Sabine, J. Martin HernandezAyon, D. Ianson, and B. Hales. 2008. Evidence for upwelling of corrosive “acidified” water onto the continental shelf. Science 320(5882):14901492.
Guan Y, S. Hohn, A. Merico. 2015. Suitable Environmental Ranges for Potential Coral Reef Habitats in the Tropical Ocean. PLoS ONE 10(6): e0128831. https://doi.org/10.1371/journal.pone.0128831
Guinotte, J.M., R.W. Buddemeier, and J.A. Kleypas. 2003. Future coral reef habitat marginality: temporal and spatial effects of climate change in the Pacific basin. Coral Reefs 22, 551–558 (2003). https://doi.org/10.1007/s00338-003-0331-4
Harvey, B.P., N.J. McKeown, S.P.S. Rastrick, C. Bertolini, A. Foggo, H. Graham, J.M. Hall-Spencer, M. Milazzo, P.W. Shaw, D.P. Small, and P.J. Moore. 2016. Individual and population-level responses to ocean acidification. Sci. Rep. 6, 20194; doi: 10.1038/srep20194.
Jokiel PL. 2013 Coral reef calcification: carbonate, bicarbonate and proton flux under conditions of increasing ocean acidification. Proc R Soc B 280: 20130031. http://dx.doi.org/10.1098/rspb.2013.0031
Kleypas, J.A., J.W. McManu, A.B.M. Lambert. 1999. Environmental limits to coral reef development: Where do we draw the line?. Amer. Zool. 39:146-159
Kroeker, K., M. Micheli, and M. Gambi. 2012. Ocean acidification causes ecosystem shifts via altered competitive interactions. Nature Clim Change 3, 156–159. https://doi.org/10.1038/nclimate1680
Kroeker KJ, R.L. Kordes, R. Crim, I.E. Hendriks, L. Ramajo, G.S. Singh, C.M. Duarte, and J-P. Gattuso. 2013. Impacts of ocean acidification on marine organisms: quantifying sensitivities and interactions with warming. Global Change Biology 19: 1884-1896.
Laffoley, D. d’A., and J.M. Baxter. 2015. The Monaco Ocean Acidification Action Plan. Heralding the next era of action on ocean acidification. 20 pp.
Thomsen, J., L. S. Stapp, K. Haynert, H. Schade, M. Danelli, G. Lannig, K. M. Wegner, F. Melzner, Naturally acidified habitat selects for ocean acidification–tolerant mussels. Sci. Adv. 3, e1602411
บทความล่าสุด

ปลาผีเสื้อพระจันทร์

ปลาตะพัด